各種受託試験のご案内
一般受託試験は、厚労省のガイドラインはもとより国際標準であるISO10993、FDA、ASTM、OECDなどによって推奨される試験も実施可能です。
受託可能な試験項目
| 項目 | 試験種 |
|---|---|
| 一般毒性試験 | 単回投与毒性試験 |
| 短期反復投与毒性試験 | |
| 長期反復投与毒性試験 | |
| 免疫毒性試験 | 皮膚感作性試験 (Maximization test, LLNA 等) |
| 免疫毒性試験 | |
| 変異原性・遺伝毒性・細胞毒性 | 細菌を用いる復帰変異試験 |
| 染色体異常試験 (in vitro) | |
| 小核試験 (in vivo) | |
| 不定期DNA合成 (UDS) 試験 (各種臓器, ミクロARGによる評価) | |
| 細胞毒性試験 | |
| 各種 in vitro 代替法試験 | |
| 培養細胞品質試験 | |
| 代謝・分析・生化学 | 代謝分析試験 |
| 生化学試験 | |
| 薬剤の安定性試験 | |
| 薬物および生体成分の測定 | |
| 局所刺激性 | 眼刺激性試験 |
| 皮内反応試験 | |
| 皮膚一次刺激性試験 | |
| 各種累積刺激性試験 | |
| 各種粘膜刺激性試験 | |
| 埋植試験 | |
| 家兎眼装用試験 | |
| 血液への影響 | 血液適合性試験 |
| 溶血性試験 | |
| 発熱性物質 | エンドトキシン試験 |
| 発熱性物質試験 |
FAQ (よくあるご質問)

お問合せの方法について
⇒ 「お問い合わせ」ページの「お問い合わせフォーム」に詳細をご記入のうえ、送信してください。電話でのお問い合わせもお受けいたします。
⇒ 土、日、祝祭日をのぞく平日が営業日です(12月29日~1月3日は休業)。電話でのお問い合わせは、平日の午前9時から午後6時まで承ります。
委託の可否について
⇒ 実施可能な場合もあります。ご依頼の内容に応じて個別に検討しますのでお問い合わせください。
⇒ いずれもお受けすることができます。弊所の各GLP適合確認書はこちら(各種適合性調査結果)を参照してください。
⇒ 試験の目的(被験物質)に応じて、最新の基準に沿った試験項目をご提案します。医療機器の試験項目はこちら(医療機器の星取表)を参照してください。
⇒ 和文と英文に対応可能です。
⇒ 原則として弊所へご依頼いただいた試験の報告書に限ってお受けしますが、ご相談に応じます。
⇒ 法人からのご依頼のみお受けしています。
試験委託料について
⇒ お問い合わせいただいた内容により、お見積りします。
試験の依頼方法などについて
⇒ 依頼方法は2つあります。
(1)「試験委託契約書(ご依頼案件に限定した契約書)」の締結による委受託
(2)「試験委託基本契約書(反復継続される個々の取引に共通して適用される契約内容をあらかじめ合意しておくための契約書)」を締結のうえ、「試験検査依頼書(個々のお申込み書式)」の授受による委受託
詳細なフローはこちら(受託試験の流れ)を参照してください。
*なお、GMP試験(出荷検査、ロットチェック)は(2)に加えて「GQP取決め書」の締結をお願いしています。
⇒ 弊所担当と「送付量、保管条件、送付日」について確認の後に、被験物質管理責任者宛にお送りください。GLP試験の場合は、弊所から提示する「被験物質送付依頼書」の内容を確認後にお送りください。
⇒ 医療機器の血液適合性試験(in vitro血栓性)では、申請予定国(地域)において既承認の類似製品を対照物質としてご提供いただく必要があります。
⇒ 被験物質が試験期間中に変化しないことを示す資料のことです。GLP試験の場合、最終報告書に「被験物質の安定性」に関する記載が必要です。
⇒ 試験項目によっては滅菌が必須となります。被験物質が非(未)滅菌品の場合は、高圧蒸気(オートクレーブ)滅菌あるいはEOG(エチレンオキサイドガス)滅菌の実施が可能です。
詳細は試験ご依頼時にお問い合わせください。
⇒ 成分分析はお受けしていません。
⇒ 可能ですが、実験動物の無償キャンセル期限を過ぎている場合や、すでに試験作業に着手している場合等は、実費を申し受けます。
医療機器の試験について
⇒ 以下で情報を提供しています。
(1)「医療機器等の生物学的安全性試験の手引き」
医療機器の生物学的安全性試験を計画し、試験を弊所に委託あるいはご検討くださる際にご利用いただいています。医療機器メーカー様等を対象に無償・送料弊所負担にて郵送いたします。お問い合わせフォームよりお申込みください。
なお、同業他社様、個人の方からのお申込みはお断りさせていただきます。その他弊所の判断によりお渡しできない場合がございますので予めご了承ください。
(2)「医療機器安全性試験セミナー」
皆様が興味を持たれる時勢に合ったテーマやご要望の多いテーマについて、年3回程度開催しています(医療機器安全性試験セミナーのページリンク)。
受託試験の流れ
一般的な受託試験の流れについての模式図を示しました。ご不明な点はメールまたはお電話にてお問い合わせください。
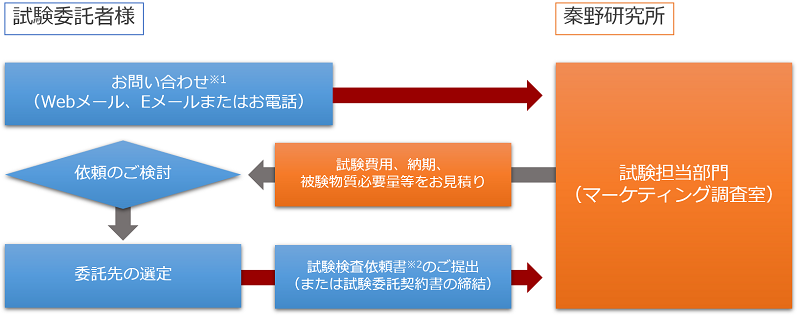



※1 お問い合わせの内容、試験の結果等は全て秘密厳守で対応いたします。また、ご要望に応じて秘密保持契約を締結いたします。
※2 試験委託基本契約を締結の上、秦野研究所所定の様式にてご提出ください。
※3 被験物質の授受に関しては別途ご案内いたします。
お申込様式ダウンロード
- 1検体用(Word ファイル)、記載方法の手引き[1検体・pdf]
- 複数検体用(Word ファイル)、記載方法の手引き[複数検体・pdf]
- GMP試験用のお申込様式は別途にご用意しております。ご入り用の方は、弊所受付窓口までメールにてご連絡下さい。
安全性試験をご依頼の場合は、試験開始前に被験物質に関する情報を、弊所の所定書式(被験物質取扱確認書)にて、ご提供いただいております。
様式は別途ご用意しておりますので、ご入り用の方は、弊所受付窓口までメールにてご連絡下さい。